Học môn Hóa Học bạn không thể bỏ qua kiến thức quan trọng đó là Oleum. Nó được xem là một chất thường gặp, nhưng lại rất nhiều em học sinh bỏ lỡ kiến thức quan trọng này. Bởi vậy, bài viết hôm nay Tin Gen Z sẽ giới thiệu chi tiết đến bạn đọc khái niệm, oleum có công thức tổng quát là gì? Và cho một số bài tập minh họa chi tiết nhất.
Xem thêm:
- [Giải Đáp] Magie Photphua có công thức là gì?
- Glixerol là gì? Glixerol có công thức là gì? Tính chất, điều chế?
- Công thức cấu tạo của Axetilen và bài tập về Axetilen có lời giải
Oleum là gì?
Oleum chính là tên gọi của một loại axit sunfuric. Ngoài ra, nó còn được biết đến với những tên gọi khác là axit Nordhausen, axit sunfuric bốc khói (bởi vì nó có khói giống khói của dầu).
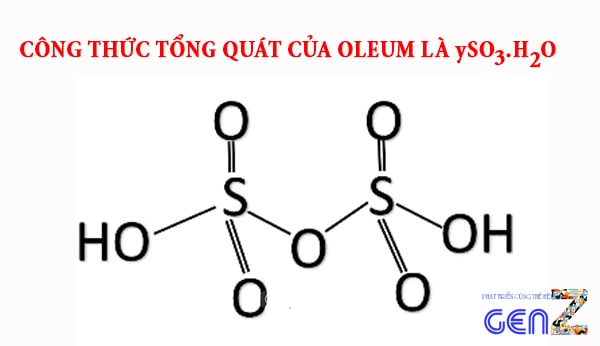
Oleum có công thức tổng quát là gì?
Oleum có công thức tổng quát là ySO3.H2O (với y là tổng hàm lượng mol lưu huỳnh trioxide). Hay nó cũng có thể được biểu thị theo công thức là H2SO4.xSO3 (với x được xác định là hàm lượng mol lưu huỳnh trioxide tự do).
Oleum tác dụng với nước sẽ sinh ra H2SO4 đặc nóng:
H2SO4.nSO3 + nH2O→ (n + 1)H2SO4
Biện pháp sản xuất Oleum đạt chuẩn
Oleum được sản xuất trong quá trình tiếp xúc, trong đó lưu huỳnh bị oxy hóa thành lưu huỳnh trioxide, và nó được hòa tan trong axit sunfuric đậm đặc.
- SO3 có thể tan trong H2SO4 theo tỷ lệ nhất định và được tạo ra oleum (H2SO4.nSO3). Nó xuất hiện nhiều nhất trong giai đoạn như sau:
SO3 + H2O → H2SO4
- Oleum có thể tác dụng với nước sinh ra H2SO4 đặc nóng theo phương trình như sau:
H2SO4.nSO3 + H2O → H2SO4
Ứng dụng của Oleum trong cuộc sống
Có thể bạn chưa biết oleum được ứng dụng nhiều trong đời sống và sản xuất.
Sử dụng để giúp điều chế H2SO4
Oleum chính là một loại chất trung gian vô cùng quan trọng trong việc sản xuất ra axit sunfuric do khả năng hydrat hóa cao. Khi mà SO3 được thêm vào nước thì sẽ tạo thành một màn mỏng là axit sunfuric nhưng khó xác định.
Ngoài ra, SO3 được thêm vào axit sunfuric đậm đặc dễ hòa tan, tạo thành quầng sau đó được pha loãng với nước để tạo thành H2SO4 đậm đặc bổ sung.
Sử dụng trong nghiên cứu
Oleum chính là một loại thuốc thử có tính ăn mòn vô cùng cao. Do vậy mà nó được sử dụng trong một số trường hợp để nghiên cứu hóa học hữu cơ. Bên cạnh đó, nó cũng được sử dụng để làm thuốc thử trong quá trình nitrat hóa thứ cấp của nitrobenzene để giúp đưa nhóm nitro thứ hai vào vòng.
Sản xuất thuốc nổ
Oleum được dùng trong sản xuất nhiều chất nổ với ngoại lệ đáng để ý là nitrocellulose.

Làm một chất trung gian trong vận chuyển các loại chất khác
Oleum chính là chất vô cùng hữu ích để giúp vận chuyển những hợp chất axit sunfuric trong những toa xe lửa, giữa các nhà máy lọc dầu và vận chuyển đến tay của người sử dụng.
Bên cạnh đó, oleum là chất ít ăn mòn kim loại hơn H2SO4 bởi nó không có nước tự do để tấn công những bề mặt. Do vậy mà H2SO4 đôi khi được cô đặc thành oleum cho những đường ống trong nhà máy và sau đó được pha loãng trở lại thành axit để dùng trong những phản ứng công nghiệp.
Những bài tập về Oleum có lời giải dễ hiểu
Bài tập 1: Có 300 ml dung dịch H2SO4 98% có khối lượng riêng là d = 194 g/cm3. Thể tích nước cần sử dụng để pha loãng H2SO4 trên thành H2SO4 35% là bao nhiêu?
Lời giải
Khối lượng H2SO4 98% là:
mddH2SO4 = V.d = 300.1,94 = 582 (g)
Áp dụng quy tắc đường chéo ta được:
582 gam dung dịch H2SO4 có C% = 98%
X gam dung dịch H2O có C% = 0%
=> 582/x = 35%/63% => x = (582.63)/35 = 1047,6 (g)
Bởi vì dH2O = 1g/ml nên VH2O = mH2O/d = 1047,6/1 = 1047,6 (ml)
Bài tập 2: Trộn 300 gam dung dịch H2SO4 12% với 400 gam dung dịch H2SO4 40% thu được 600 gam dung dịch H2SO4 a%. Hỏi giá trị của a là bao nhiêu?
Lời giải
mH2SO4(sau) = (12.300)/100 + (400.40)/100 = 196 (g)
mdd (sau) = 300 + 400 = 700 (g)
=> C% (sau) = (196/700).100% = 28 %
Hy vọng với bài viết trên của chúng tôi sẽ giúp bạn hiểu về oleum, nhớ công thức tổng quát và dễ dàng giải những bài tập về oleum nhé. Nếu như trong quá trình học tập bạn vẫn còn điều gì thắc mắc, hoặc khó khăn trong việc giải bài tập hãy để lại bình luận trong bài viết để chúng tôi cùng bạn giải đáp thắc mắc đó nhé.
